2025年1月21日消息,CMDE對外發布《創新醫療器械特別審查申請審查結果公示(2025年第1號)》(以下簡稱“《公示》”)。 《公示》披露,依據國家藥品監督管理局《創新醫療器械特別審查程序》(國家藥監局2018年第83號公告)要求,創新醫療器械審查辦公室組織有關專家對創新醫療器械特別審查申請進行了審查,擬同意以下申請項目進入特別審查程序,現予以公示。分別為: 1.產品名稱:脫細胞結膜基質 申 請 人:拜歐迪賽爾(成都)生物科技有限公司 2.產品名稱:外科生物補片 申 請 人:卓阮醫療科技(蘇州)有限公司 3.產品名稱:青光眼引流器 申 請 人:蘇州朗目醫療科技有限公司 4.產品名稱:金屬增材制造椎間融合器 申 請 人:北京愛康宜誠醫療器材有限公司 5.產品名稱:自膨式可載粒子門靜脈支架 申 請 人:南京融晟醫療科技有限公司 6.產品名稱:連續無針給藥系統 申 請 人:江蘇樂聚醫藥科技有限公司 7.產品名稱:顱內取栓支架 申 請 人:紐瓦斯克醫療科技有限公司 8.產品名稱:分支型術中支架系統 申 請 人:江蘇百優達生命科技有限公司 9.產品名稱:可降解卵圓孔未閉封堵器 申 請 人:無憂跳動醫療科技(深圳)有限公司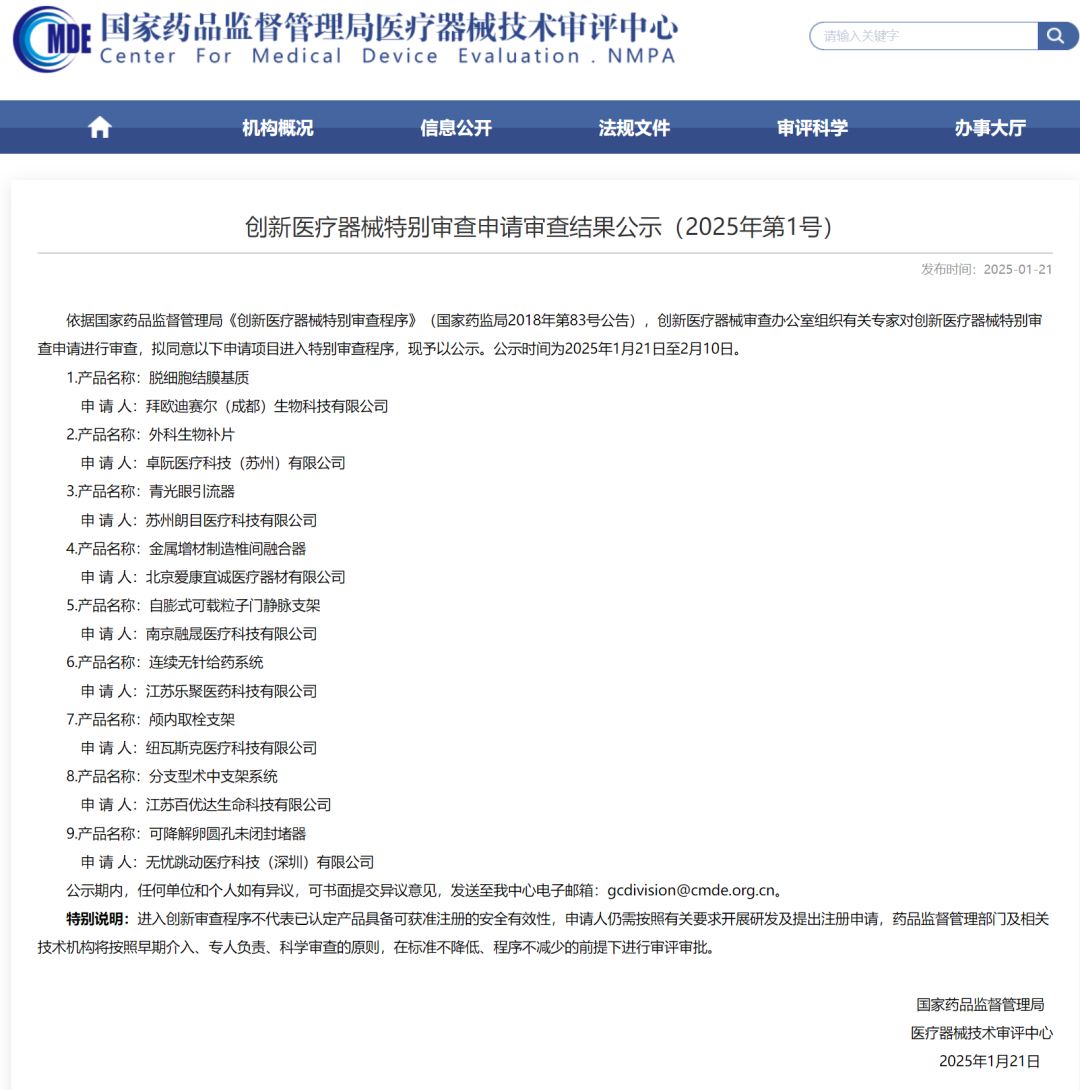
注:文章來源于網絡,如有侵權,請聯系刪除




 全部商品分類
全部商品分類